硫酸是一种活泼的二元无机强酸,能和许多金属发生反应。高浓度的硫酸有强烈吸水性,可用作脱水剂,碳化木材、纸张、棉麻织物及生物皮肉等含碳水化合物的物质。与水混合时,亦会放出大量热能。其具有强烈的腐蚀性和氧化性,故需谨慎使用。是一种重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等,也广泛应用于净化石油、金属冶炼以及染料等工业中。常用作化学试剂,在有机合成中可用作脱水剂和磺化剂。
化学性质
腐蚀性
纯硫酸加热至290℃分解放出部分三氧化硫,直至酸的浓度降到98.3%为止,这时硫酸为恒沸溶液,沸点为338°C。无水硫酸体现酸性是给出质子的能力,纯硫酸仍然具有很强的酸性,98%硫酸与纯硫酸的酸性基本上没有差别,而溶解三氧化硫的发烟硫酸是一种超酸体系,酸性强于纯硫酸,但是广泛存在一种误区,即稀硫酸的酸性强于浓硫酸,这种想法是错误的。的确,稀硫酸第一步电离完全,产生大量的水合氢离子H3O+;但是浓硫酸和水一样,自身自偶电离会产生一部分硫酸合氢离子H3SO4+,正是这一部分硫酸合质子,导致纯硫酸具有非常强的酸性,虽然少,但是酸性却要比水合质子强得多,所以纯硫酸的哈米特酸度函数高达-12.0。
在硫酸溶剂体系中,H3SO4+经常起酸的作用,能质子化很多物质产生离子型化合物:
NaCl+ H2SO4==NaHSO4+HCl(不加热都能很快反应)
KNO3+ H2SO4→K++HSO4-+HNO3
HNO3+ H2SO4→NO2++H3O++2HSO4-
CH3COOH+ H2SO4→CH3C(OH)2++HSO4-
HSO3F+ H2SO4→H3SO4++SO3F-(氟磺酸酸性更强)
上述与HNO3的反应所产生的NO2+,有助于芳香烃的硝化反应。
浓硫酸特性
1.脱水性
脱水指浓硫酸脱去非游离态水分子或按照水的氢氧原子组成比脱去有机物中氢氧元素的过程。就硫酸而言,脱水性是浓硫酸的性质,而非稀硫酸的性质,浓硫酸有脱水性且脱水性很强,脱水时按水的组成比脱去。物质被浓硫酸脱水的过程是化学变化,反应时,浓硫酸按水分子中氢氧原数的比(2:1)夺取被脱水物中的氢原子和氧原子或脱去非游离态的结晶水,如五水硫酸铜(CuSO4·5H2O)。

浓硫酸迅速蚀穿毛巾
可被浓硫酸脱水的物质一般为含氢、氧元素的有机物,其中蔗糖、木屑、纸屑和棉花等物质中的有机物,被脱水后生成了黑色的炭,这种过程称作炭化。一个典型的炭化现象是蔗糖的黑面包反应。在200mL烧杯中放入20g蔗糖,加入几滴水,水加适量,搅拌均匀。然后再加入15mL质量分数为98%的浓硫酸,迅速搅拌。观察实验现象。可以看到蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状的炭,反应放热,还能闻到刺激性气体。C12H22O11==浓硫酸==12C+11H2O
同时进行碳与浓硫酸反应:
C+2H2SO4(浓)==加热==CO2↑+2SO2↑+2H2O
2.强氧化性
(1)与金属反应
①常温下浓硫酸能使铁、铝等金属钝化。②加热时,浓硫酸可以与除金、铂之外的所有金属反应,生成高价金属硫酸盐,本身一般被还原成二氧化硫。
Cu+2H2SO4(浓)==加热==CuSO4+SO2↑+2H2O
2Fe+6H2SO4(浓)==加热==Fe2(SO4)3+3SO2↑+6H2O
在上述反应中,硫酸表现出了强氧化性和酸性。
(2)与非金属反应
热的浓硫酸可将碳、硫、磷等非金属单质氧化到其高价态的氧化物或含氧酸,本身被还原为二氧化硫。在这类反应中,浓硫酸只表现出氧化性。
C+2H2SO4(浓)=加热=CO2↑+2SO2↑+2H2O
S+H2SO4(浓)==加热==3SO2↑+2H2O
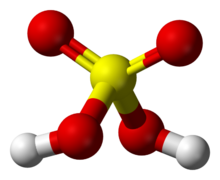
硫酸分子的球棍模型
2P+5H2SO4(浓)==加热==2H3PO4+5SO2↑+2H2O(3)与其他还原性物质反应
浓硫酸具有强氧化性,实验室制取硫化氢、溴化氢、碘化氢等还原性气体不能选用浓硫酸。
H2S+H2SO4(浓)==S↓+SO2↑+2H2O
2HBr+H2SO4(浓)==Br2↑+SO2↑+2H2O
2HI+H2SO4(浓)==I2↓+SO2↑+2H2O
稀硫酸特性
性质
可与多数金属(比铜活泼)和绝大多数金属氧化物反应,生成相应的硫酸盐和水;
可与所含酸根离子对应酸酸性比硫酸根离子弱的盐反应,生成相应的硫酸盐和弱酸;
可与碱反应生成相应的硫酸盐和水;
可与氢前金属在一定条件下反应,生成相应的硫酸盐和氢气;
加热条件下可催化蛋白质、二糖和多糖的水解;
能与指示剂作用,使紫色石蕊试液变红,使无色酚酞试液不变色。
检验
所需药品:经过盐酸酸化的氯化钡溶液,镁粉。
检验方法:使用经过盐酸(HCl)酸化的的氯化钡(BaCl2)。向待测物溶液滴入几滴经过盐酸酸化的氯化钡溶液,震荡,如果产生白色沉淀;向溶液中加入镁粉后生成可燃性气体,则待测溶液中含有硫酸。但此方法仅限中学阶段。
常见误区
稀硫酸在中学阶段,一般当成H2SO4=2H++SO42-,两次完全电离,其实不是这样的。根据硫酸酸度系数pKa1=-3.00,pKa2=1.99,其二级电离不够充分,在稀硫酸中HSO4-=可逆=H++SO42-,并未完全电离,1mol/L的硫酸一级电离完全,二级电离约电离10%,也就是溶液中仍存在大量的HSO4-。而即使是NaHSO4溶液0.1mol/L时,硫酸氢根也只电离了约30%。








